Lista de elementos
»
actínio
»
alumínio
»
amerício
»
argão
»
arsênico
»
astatine
»
azoto
»
bário
»
Berílio
»
bismuto
»
bohrium
»
Boro
»
bromo
»
cádmio
»
cálcio
»
carbono
»
cério
»
césio
»
cloro
»
cobalto
»
cobre
»
crômio
»
dubnium
»
enxofre
»
erbium
»
escândio
»
estanho
»
európio
»
fermium
»
ferro
»
fleróvio
»
flúor
»
fósforo
»
francium
»
gálio
»
germânio
»
háfnio
»
hassium
»
hélio
»
holmium
»
índio
»
iodo
»
irídio
»
itérbio
»
ítrio
»
lantânio
»
lead
»
lítio
»
lutécio
»
magnésio
»
manganês
»
mercúrio
»
neodímio
»
néon
»
neptúnio
»
Nihonium
»
nióbio
»
níquel
»
nobelium
»
ósmio
»
ouro
»
oxigênio
»
paládio
»
platina
»
plutônio
»
polônio
»
potássio
»
Prata
»
promécio
»
radão
»
rádio
»
rênio
»
ródio
»
rubídio
»
rutênio
»
samário
»
selênio
»
silício
»
sódio
»
tálio
»
tântalo
»
tecnécio
»
telúrio
»
Tennesse
»
térbio
»
titânio
»
tório
»
túlio
»
urânio
»
vanádio
»
xênon
»
zinco
»
zircônio
I - iodo - HALOGÊNIO NÃO METÁLICO
O iodo é um elemento químico metalóide pertencente à família dos halogênios e que ocorre na forma sólida de cor violeta intenso.
- O iodo é um halogênio extremamente reativo. Combina-se com muitos outros elementos químicos e forma moléculas voláteis.
- Também se combina com o hidrogênio para formar um composto líquido a baixas temperaturas chamado ácido hidroiódico.
- É muito solúvel em água e se dissolve para formar íons iodeto.
- O iodo tem muitos usos, inclusive em raios-x, tratamento de águas residuais para remover cloro e brometos e na fabricação de produtos químicos, como antissépticos, medicamentos e corantes.
- Também é utilizado no tratamento de certas formas de câncer e na produção de radiofármacos para exames de diagnóstico médico.
- O iodo também é usado na produção de iodo radioativo, que é usado em aplicações como radioimagem e tratamento de câncer.
- O iodo é um halogênio extremamente reativo. Combina-se com muitos outros elementos químicos e forma moléculas voláteis.
- Também se combina com o hidrogênio para formar um composto líquido a baixas temperaturas chamado ácido hidroiódico.
- É muito solúvel em água e se dissolve para formar íons iodeto.
- O iodo tem muitos usos, inclusive em raios-x, tratamento de águas residuais para remover cloro e brometos e na fabricação de produtos químicos, como antissépticos, medicamentos e corantes.
- Também é utilizado no tratamento de certas formas de câncer e na produção de radiofármacos para exames de diagnóstico médico.
- O iodo também é usado na produção de iodo radioativo, que é usado em aplicações como radioimagem e tratamento de câncer.
Sintético
Radioativo
Líquido
Gasoso
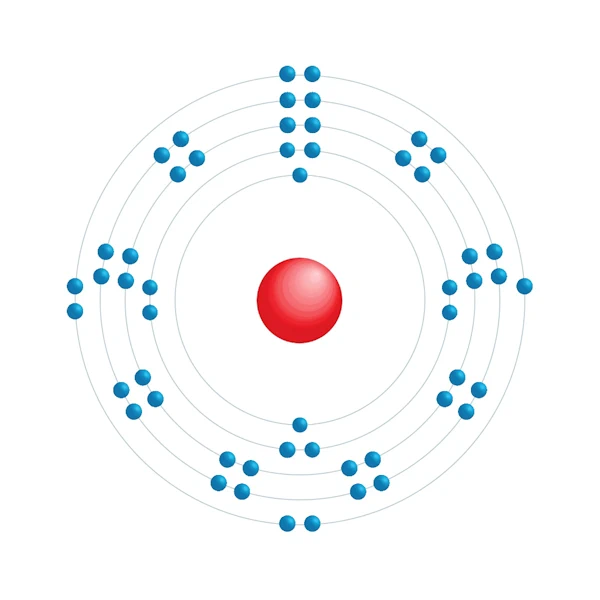
Diagrama de configuração eletrônica
| Nome | iodo |
| Número | 53 |
| Atômico | 126.90447 |
| Símbolo | I |
| Fusão | 113.5 |
| Ebulição | 184.4 |
| Densidade | 4.93 |
| Período | 5 |
| Grupo | 17 |
| Descoberta | 1811 Courtois |
| Abundância | 0.45 |
| Raio | 1.3 |
| Eletronegatividade | 2.66 |
| Ionização | 10.4513 |
| Número de isótopos | 24 |
| Configuração eletrônica | [Kr] 4d10 5s2 5p5 |
| Estados de oxidação | -1,1,3,5,7 |
| Elétron por nível de energia | 2,8,18,18,7 |
| Mineral | Dureza | Densidade |
| Aurivilliusite | 8.96 | |
| Bellingerite | 4.00 / 4.00 | 4.89 |
| Bluebellite | 1.00 / 1.00 | 4.75 |
| Brüggenite | 3.50 / 3.50 | 4.24 |
| Capgaronnite | 6.19 | |
| Carlosruizite | 2.50 / 3.00 | 3.42 |
| Coccinite | 2.00 / 2.00 | 6.00 |
| Demicheleite-(Br) | ||
| Demicheleite-(I) | ||
| Dietzeite | 3.50 / 3.50 | 3.62 |
| Fuenzalidaite | 2.50 / 3.00 | 3.31 |
| George-ericksenite | 3.00 / 4.00 | 3.04 |
| Grechishchevite | 2.50 / 2.50 | 7.16 |
| Hectorfloresite | 2.00 / 2.00 | 2.80 |
| Iodargyrite | 1.50 / 2.00 | 5.50 |
| Iodine | ||
| Lautarite | 3.50 / 4.00 | 4.52 |
| Marshite | 2.50 / 2.50 | 5.60 |
| Miersite | 2.50 / 3.00 | 5.64 |
| Moschelite | 1.50 / 2.00 | 7.00 |
| Mutnovskite | 2.00 / 2.00 | 6.18 |
| Nataliyamalikite | ||
| Perroudite | 2.00 / 2.00 | |
| Radtkeite | 2.00 / 3.00 | 7.00 |
| Salesite | 3.00 / 3.00 | 4.77 |
| Schwartzembergite | 2.50 / 2.50 | 7.39 |
| Seeligerite | 6.83 | |
| Tedhadleyite | 2.50 / 2.50 | |
| Tocornalite | 1.00 / 2.00 | |
| Vasilyevite | 3.00 / 3.00 | 9.57 |
 mineraly.fr
mineraly.fr
 mineraly.co.uk
mineraly.co.uk
 mineraly.com.de
mineraly.com.de
 mineraly.it
mineraly.it
 mineraly.es
mineraly.es
 mineraly.nl
mineraly.nl
 mineraly.pt
mineraly.pt
 mineraly.se
mineraly.se