Lista de elementos
»
actínio
»
alumínio
»
amerício
»
argão
»
arsênico
»
astatine
»
azoto
»
bário
»
Berílio
»
bismuto
»
bohrium
»
Boro
»
bromo
»
cádmio
»
cálcio
»
carbono
»
cério
»
césio
»
cloro
»
cobalto
»
cobre
»
crômio
»
dubnium
»
enxofre
»
erbium
»
escândio
»
estanho
»
európio
»
fermium
»
ferro
»
fleróvio
»
flúor
»
fósforo
»
francium
»
gálio
»
germânio
»
háfnio
»
hassium
»
hélio
»
holmium
»
índio
»
iodo
»
irídio
»
itérbio
»
ítrio
»
lantânio
»
lead
»
lítio
»
lutécio
»
magnésio
»
manganês
»
mercúrio
»
neodímio
»
néon
»
neptúnio
»
Nihonium
»
nióbio
»
níquel
»
nobelium
»
ósmio
»
ouro
»
oxigênio
»
paládio
»
platina
»
plutônio
»
polônio
»
potássio
»
Prata
»
promécio
»
radão
»
rádio
»
rênio
»
ródio
»
rubídio
»
rutênio
»
samário
»
selênio
»
silício
»
sódio
»
tálio
»
tântalo
»
tecnécio
»
telúrio
»
Tennesse
»
térbio
»
titânio
»
tório
»
túlio
»
urânio
»
vanádio
»
xênon
»
zinco
»
zircônio
mineralogia
elementos
Rb rubídio
Rb - rubídio - METAL ALCALINO
O rubídio é um elemento químico metálico que se encontra no grupo 1 (alcalino) da tabela periódica. Seu símbolo químico é Rb e seu número atômico é 37. Seu nome vem da palavra latina "rubidius" que significa "vermelho", devido à cor vermelha brilhante que o vapor de rubídio produz quando exposto ao ar.
O rubídio é o elemento químico mais reativo dos álcalis e possui uma configuração eletrônica externa semelhante à do potássio e do sódio. É também o mais abundante dos alcalinos.
O rubídio metálico é muito maleável e dúctil e é mais volátil que o potássio e o sódio. É solúvel em água e se transforma em íons Rb+. Este íon é fortemente oxidante e reage facilmente com o oxigênio e a umidade do ar.
O rubídio é usado em uma variedade de indústrias, incluindo a indústria eletrônica e em sistemas de controle de relógio atômico. Também é usado como catalisador na indústria de polímeros e na indústria automotiva. É usado como espectrofotômetro em análises químicas e pode ser usado para produzir rubídio-87, que é um isótopo radioativo usado em medicina e pesquisa.
O rubídio também é um nutriente importante. Está presente nos alimentos e é essencial para o bom funcionamento do coração e do sistema nervoso. O rubídio é um elemento essencial para a boa saúde do organismo.
O rubídio é o elemento químico mais reativo dos álcalis e possui uma configuração eletrônica externa semelhante à do potássio e do sódio. É também o mais abundante dos alcalinos.
O rubídio metálico é muito maleável e dúctil e é mais volátil que o potássio e o sódio. É solúvel em água e se transforma em íons Rb+. Este íon é fortemente oxidante e reage facilmente com o oxigênio e a umidade do ar.
O rubídio é usado em uma variedade de indústrias, incluindo a indústria eletrônica e em sistemas de controle de relógio atômico. Também é usado como catalisador na indústria de polímeros e na indústria automotiva. É usado como espectrofotômetro em análises químicas e pode ser usado para produzir rubídio-87, que é um isótopo radioativo usado em medicina e pesquisa.
O rubídio também é um nutriente importante. Está presente nos alimentos e é essencial para o bom funcionamento do coração e do sistema nervoso. O rubídio é um elemento essencial para a boa saúde do organismo.
Sintético
Radioativo
Líquido
Gasoso
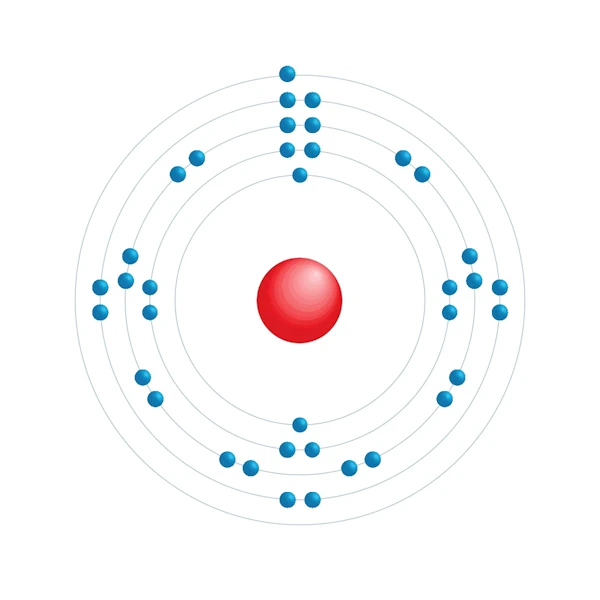
Diagrama de configuração eletrônica
| Nome | rubídio |
| Número | 37 |
| Atômico | 85.4678 |
| Símbolo | Rb |
| Fusão | 39 |
| Ebulição | 688 |
| Densidade | 1.532 |
| Período | 5 |
| Grupo | 1 |
| Descoberta | 1861 Bunsen and Kirchoff |
| Abundância | 90 |
| Raio | 3 |
| Eletronegatividade | 0.82 |
| Ionização | 4.1771 |
| Número de isótopos | 20 |
| Configuração eletrônica | [Kr] 5s1 |
| Estados de oxidação | 1 |
| Elétron por nível de energia | 2,8,18,8,1 |
| Mineral | Dureza | Densidade |
| Eveslogite | 5.00 / 5.00 | 2.85 |
| Faizievite | 4.00 / 4.50 | 2.82 |
| Londonite | 8.00 / 8.00 | 3.34 |
| Pautovite | 2.50 / 2.50 | 3.85 |
| Pezzottaite | 8.00 / 8.00 | 2.97 |
| Pollucite | 6.50 / 6.50 | 2.90 |
| Poppiite | 3.36 | |
| Ramanite-(Rb) | ||
| Rubicline | ||
| Telyushenkoite | 6.00 / 6.00 | 2.73 |
| Voloshinite |
 mineraly.fr
mineraly.fr
 mineraly.co.uk
mineraly.co.uk
 mineraly.com.de
mineraly.com.de
 mineraly.it
mineraly.it
 mineraly.es
mineraly.es
 mineraly.nl
mineraly.nl
 mineraly.pt
mineraly.pt
 mineraly.se
mineraly.se