Lista de elementos
»
actínio
»
alumínio
»
amerício
»
argão
»
arsênico
»
astatine
»
azoto
»
bário
»
Berílio
»
bismuto
»
bohrium
»
Boro
»
bromo
»
cádmio
»
cálcio
»
carbono
»
cério
»
césio
»
cloro
»
cobalto
»
cobre
»
crômio
»
dubnium
»
enxofre
»
erbium
»
escândio
»
estanho
»
európio
»
fermium
»
ferro
»
fleróvio
»
flúor
»
fósforo
»
francium
»
gálio
»
germânio
»
háfnio
»
hassium
»
hélio
»
holmium
»
índio
»
iodo
»
irídio
»
itérbio
»
ítrio
»
lantânio
»
lead
»
lítio
»
lutécio
»
magnésio
»
manganês
»
mercúrio
»
neodímio
»
néon
»
neptúnio
»
Nihonium
»
nióbio
»
níquel
»
nobelium
»
ósmio
»
ouro
»
oxigênio
»
paládio
»
platina
»
plutônio
»
polônio
»
potássio
»
Prata
»
promécio
»
radão
»
rádio
»
rênio
»
ródio
»
rubídio
»
rutênio
»
samário
»
selênio
»
silício
»
sódio
»
tálio
»
tântalo
»
tecnécio
»
telúrio
»
Tennesse
»
térbio
»
titânio
»
tório
»
túlio
»
urânio
»
vanádio
»
xênon
»
zinco
»
zircônio
Ga - gálio - METAL POBRE
O gálio é um elemento químico metálico de símbolo Ga. É o elemento químico com número atômico 31 e massa atômica 69,723 g/mol. Sua energia de ligação atômica é de 624,5 kJ/mol.
O gálio tem um átomo monoatômico que faz ligações covalentes com outros átomos. Tem uma estrutura cúbica com faces centrais. Sua cor é cinza prateado e tem uma dureza relativamente baixa.
O gálio tem uma temperatura de fusão muito baixa (29,76°C) e uma temperatura de ebulição (2402°C). Seu ponto de fusão é usado para sensores de uso geral porque reage com o calor e fornece controle de temperatura preciso.
O gálio é muito solúvel em materiais orgânicos e em ácidos fortes, mas é insolúvel em água. Também se mistura facilmente com outros elementos para formar ligas.
O gálio também é utilizado na fabricação de LEDs (iluminação de estado sólido) e na indústria de computadores para a produção de processadores, memória e circuitos integrados.
O gálio também é usado na indústria médica para a produção de radiofármacos e produtos de diagnóstico. Também é usado na produção de cosméticos e produtos farmacêuticos. Também é utilizado na indústria de materiais devido às suas propriedades térmicas e químicas.
O gálio tem um átomo monoatômico que faz ligações covalentes com outros átomos. Tem uma estrutura cúbica com faces centrais. Sua cor é cinza prateado e tem uma dureza relativamente baixa.
O gálio tem uma temperatura de fusão muito baixa (29,76°C) e uma temperatura de ebulição (2402°C). Seu ponto de fusão é usado para sensores de uso geral porque reage com o calor e fornece controle de temperatura preciso.
O gálio é muito solúvel em materiais orgânicos e em ácidos fortes, mas é insolúvel em água. Também se mistura facilmente com outros elementos para formar ligas.
O gálio também é utilizado na fabricação de LEDs (iluminação de estado sólido) e na indústria de computadores para a produção de processadores, memória e circuitos integrados.
O gálio também é usado na indústria médica para a produção de radiofármacos e produtos de diagnóstico. Também é usado na produção de cosméticos e produtos farmacêuticos. Também é utilizado na indústria de materiais devido às suas propriedades térmicas e químicas.
Sintético
Radioativo
Líquido
Gasoso
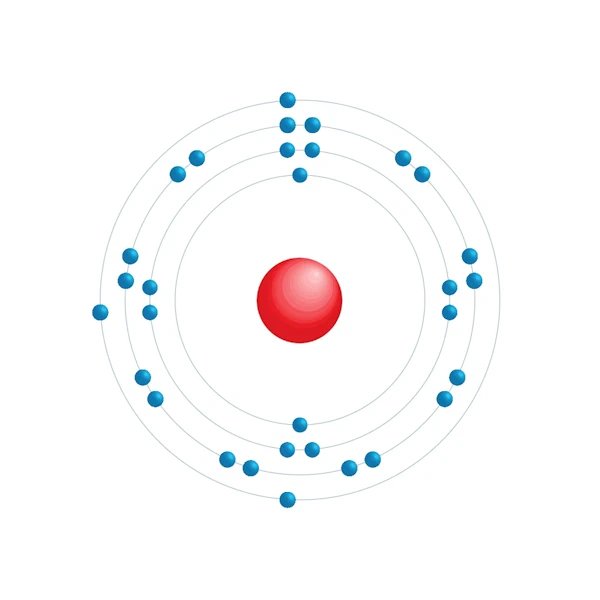
Diagrama de configuração eletrônica
| Nome | gálio |
| Número | 31 |
| Atômico | 69.723 |
| Símbolo | Ga |
| Fusão | 29.8 |
| Ebulição | 2403 |
| Densidade | 5.907 |
| Período | 4 |
| Grupo | 13 |
| Descoberta | 1875 de Boisbaudran |
| Abundância | 19 |
| Raio | 1.8 |
| Eletronegatividade | 1.81 |
| Ionização | 5.9993 |
| Número de isótopos | 14 |
| Configuração eletrônica | [Ar] 3d10 4s2 4p1 |
| Estados de oxidação | 1,2,3 |
| Elétron por nível de energia | 2,8,18,3 |
| Mineral | Dureza | Densidade |
| Calvertite | 4.00 / 5.00 | 5.24 |
| Dissakisite-(La) | 6.50 / 7.00 | 3.79 |
| Eyselite | 3.64 | |
| Ferrohögbomite-2N2S | 6.00 / 7.00 | |
| Gallite | 3.00 / 3.50 | 4.20 |
| Gallobeudantite | 4.00 / 4.00 | 4.58 |
| Galloplumbogummite | 4.62 | |
| Ishiharaite | ||
| Krieselite | 5.50 / 6.50 | 4.07 |
| Maikainite | 4.00 / 4.00 | 4.45 |
| Ovamboite | 3.50 / 3.50 | 4.74 |
| Söhngeite | 4.00 / 4.50 | 3.84 |
| Tsumgallite | 1.50 / 2.50 | 5.08 |
| Zincobriartite |
 mineraly.fr
mineraly.fr
 mineraly.co.uk
mineraly.co.uk
 mineraly.com.de
mineraly.com.de
 mineraly.it
mineraly.it
 mineraly.es
mineraly.es
 mineraly.nl
mineraly.nl
 mineraly.pt
mineraly.pt
 mineraly.se
mineraly.se